Por Maribel Ramírez Coronel
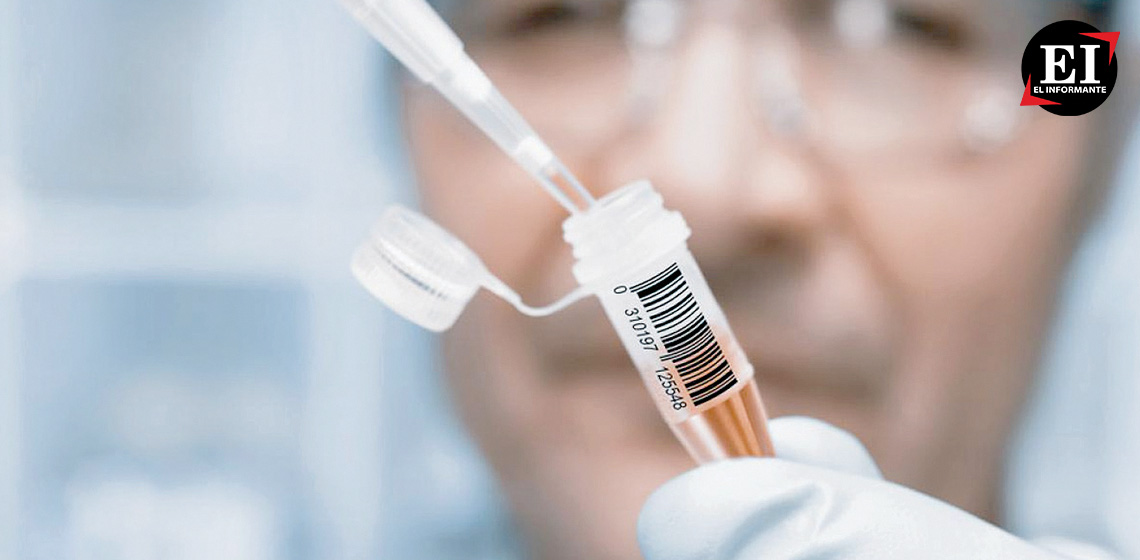
La inversión en investigación y desarrollo de la industria farmacéutica mundial anda buscando destinos, y América Latina es uno donde hay gran oportunidad y también necesidad de atraerla porque implica impulsar el desarrollo científico, empleos de alta calidad y bien remunerados, y sobre todo la llegada de tratamientos de última generación para los pacientes.
Hoy los 33 países de la región latinoamericana no están suficientemente representados pues teniendo casi 10% de la población mundial (cerca de 650 millones de habitantes), apenas recibe 5.4% de los estudios clínicos mediante los que se prueban los nuevos medicamentos. Conforme Citeline de Clinical Intelligence, de los 158,199 ensayos corriendo hoy en día, los que corren en esta región son 8,598.
Y en cáncer la cosa está peor pues de 46,549 protocolos clínicos que están en busca de opciones terapéuticas oncológicas, solamente 2,041 incluyen instituciones médicas de algún país de Latinoamérica. Es en este segmento donde menos representados estamos los latinoamericanos, pues somos más considerados en otras áreas como enfermedades infecciosas (29%) o medicina general (38%) e incluso en estudios con pacientes aleatorizados la proporción de pacientes de esta región se ha incrementado notoriamente (de 10 a 27% en los últimos cuatro años.
Estos datos fueron expuestos en el 21 Seminario Latinoamericano de Periodismo en Ciencia y Salud que organiza esta semana la farmacéutica MSD en la ciudad de México donde se hablaron de todos los retos que tenemos para participar más y mejor en la investigación y desarrollo de nuevas opciones terapéuticas para atender a las enfermedades.
Una de ellas es la parte regulatoria, ya que el sector farmacéutico es de los más regulados y con razón porque se trata de productos que ingerimos en el organismo, es decir que una exigente regulación va en favor de la seguridad del paciente, pero también de las empresas productoras que así garantizan que no haya riesgo en el consumo de sus productos. Pero en el caso de la región latinoamericana aún falta que sigan avanzando. En general las agencias de nuestros países tienen procesos lentos que tardan en dar autorizaciones y como hay una competencia de todo el mundo por atraer esas inversiones y estudios, por lo general nos vamos quedando al último tanto en la llegada de protocolos como luego en la llegada de los fármacos resultantes.
En este contexto es muy importante el evento que arranca hoy de la Mesa Regulatoria Mesoamericana, un proyecto que busca la cooperación precisamente en regulación sanitaria y contribuir a la salud pública en sus 10 países miembros: Belice, Colombia, Costa Rica, El Salvador, Guatemala, Honduras, México, Nicaragua, Panamá y República Dominicana, pero donde también vienen como asistentes funcionarios de regulación de otros países, incluido Estados Unidos. Es organizado por Cofepris, que lleva Alejandro Svarch y la Cancillería a través de la Agencia Mexicana de Cooperación Internacional para el Desarrollo (Amexcid). Como parte de ello México será sede de la XI Conferencia Panamericana para la Armonización de la reglamentación Farmacéutica (CPARF). El evento tendrá hoy su acto inaugural en la sede de la Secretaría de Relaciones Exteriores.
Es importante el factor de que la población latina, donde hay una diversidad poblacional con muchas minorías por ejemplo de indígenas, sea considerada en el desarrollo de los nuevos medicamentos porque así se comprueba con mayor certeza la eficacia y seguridad de los tratamientos. Y es que a final de cuentas esos medicamentos sí terminamos recibiéndolos cuando ya son autorizados en nuestros países para ser consumidos por personas latinoamericanas, pero sería mucho mejor si también fueron lo suficientemente probadas en nuestras poblaciones cuando estuvieron en desarrollo.
Andy Lee, el líder global de operaciones en ensayos clínicos de MSD, nos comentó que en el caso de México sí han notado que el regulador mexicano Cofepris con su proceso de digitalización está logrando reactivar la autorización de protocolos, pero aún hay un camino por recorrer para que muchos más pacientes de México contribuyan en los estudios clínicos de los nuevos medicamentos.